Введите слово или словосочетание на любом языке 👆
Язык:
Перевод и анализ слов искусственным интеллектом
На этой странице Вы можете получить подробный анализ слова или словосочетания, произведенный с помощью лучшей на сегодняшний день технологии искусственного интеллекта:
- как употребляется слово
- частота употребления
- используется оно чаще в устной или письменной речи
- варианты перевода слова
- примеры употребления (несколько фраз с переводом)
- этимология
Что (кто) такое Гелий - определение
ИНЕРТНЫЙ ГАЗ БЕЗ ЦВЕТА, ВКУСА И ЗАПАХА
He; E939; Гелий (элемент); HE; Е939; Helium; Парагелий и ортогелий; Парагелий; Ортогелий
Гелий
Гелий (химич.) - считается элементарным телом, присутствующим насолнце; он характеризуется яркой линией (длина волны 587 '5, около D),видимой в спектроскоп в выступах и пятнах солнца; линии этой нет вспектрах известных поныне элементов. Так как на солнце при особенностяхтемпературы, давлений и движений там существующих, проявляютсяобстоятельства, изменяющие спектры как видно в различии спектровгазообразных элементарных тел, то с одинаковым правом можно полагать,что линия гелия принадлежит особому, доныне неизвестному элементу, илиже, что она проявляется только при особых, доныне не воспроизведенных вопыте, условиях, имеющих место на солнце, где она видна ясно только приособых состояниях частей этого светила. Д.Менделеев.
Гелий
(лат. Helium)


символ Не, химический элемент VIII группы периодической системы, относится к инертным газам (См. Инертные газы); порядковый номер 2, атомная масса 4,0026; газ без цвета и запаха. Природный Г. состоит из 2 стабильных изотопов: 3He и 4He (содержание 4He резко преобладает).
Впервые Г. был открыт не на Земле, где его мало, а в атмосфере Солнца. В 1868 француз Ж. Жансен и англичанин Дж. Н. Локьер исследовали спектроскопически состав солнечных протуберанцев. Полученные ими снимки содержали яркую жёлтую линию (т. н. D3-линию), которую нельзя было приписать ни одному из известных в то время элементов. В 1871 Локьер объяснил её происхождение присутствием на Солнце нового элемента, который и назвали гелием (от греч. helios - Солнце). На Земле Г. впервые был выделен в 1895 англичанином У. Рамзаем из радиоактивного минерала клевеита. В спектре газа, выделенного при нагревании клевеита, оказалась та же линия.
Гелий в природе. На Земле Г. мало: 1 м3 воздуха содержит всего 5,24 см3 Г., а каждый килограмм земного материала - 0,003 мг Г. По распространённости же во Вселенной Г. занимает 2-е место после водорода: на долю Г. приходится около 23\% космической массы.
На Земле Г. (точнее, изотоп 4He) постоянно образуется при распаде урана, тория и других радиоактивных элементов (всего в земной коре содержится около 29 радиоактивных изотопов, продуцирующих 4He).
Примерно половина всего Г. сосредоточена в земной коре, главным образом в её гранитной оболочке, аккумулировавшей основные запасы радиоактивных элементов. Содержание Г. в земной коре невелико - 3 · 10-7\% по массе. Г. накапливается в свободных газовых скоплениях недр и в нефтях; такие месторождения достигают промышленных масштабов. Максимальные концентрации Г. (10-13\%) выявлены в свободных газовых скоплениях и газах урановых рудников и (20-25\%) в газах, спонтанно выделяющихся из подземных вод. Чем древнее возраст газоносных осадочных пород и чем выше в них содержание радиоактивных элементов, тем больше Г. в составе природных газов. Вулканическим газам свойственно обычно низкое содержание Г.
Добыча Г. в промышленных масштабах производится из природных и нефтяных газов как углеводородного, так и азотного состава. По качеству сырья гелиевые месторождения подразделяются: на богатые (содержание Не > 0,5\% по объёму); рядовые (0,10-0,50) и бедные < 0,10). В СССР природный Г. содержится во многих нефтегазовых месторождениях. Значительные его концентрации известны в некоторых месторождениях природного газа Канады, США (шт. Канзас, Техас, Нью-Мексико, Юта).
В природном Г. любого происхождения (атмосферном, из природных газов, из радиоактивных минералов, метеоритном и т.д.) преобладает изотоп 4He. Содержание 3He обычно мало (в зависимости от источника Г. оно колеблется от 1,3 · 10-4 до 2 · 10-8\%) и только в Г., выделенном из метеоритов, достигает 17-31,5\%. Скорость образования 4He при радиоактивном распаде невелика: в 1 т гранита, содержащего, например, 3 г урана и 15 г тория, образуется 1 мг Г. за 7,9 млн. лет; однако, поскольку этот процесс протекает постоянно, за время существования Земли он должен был бы обеспечить содержание Г. в атмосфере, литосфере и гидросфере, значительно превышающее наличное (оно составляет около 5 · 1014 м3). Такой дефицит Г. объясняется постоянным улетучиванием его из атмосферы. Лёгкие атомы Г., попадая в верхние слои атмосферы, постепенно приобретают там скорость выше 2-й космической и тем самым получают возможность преодолеть силы земного притяжения. Одновременное образование и улетучивание Г. приводят к тому, что концентрация его в атмосфере практически постоянна.
Изотоп 3He, в частности, образуется в атмосфере при бета-распаде тяжёлого изотопа Водорода - трития (Т), возникающего, в свою очередь, при взаимодействии нейтронов космического излучения с азотом воздуха:
Ядра атома 4He (состоящие из 2 протонов и 2 нейтронов), называют альфа-частицами (См. Альфа-частицы) или гелионами, - самые устойчивые среди составных ядер. Энергия связи нуклонов (протонов и нейтронов) в 4He имеет максимальное по сравнению с ядрами других элементов значение (28,2937 Мэв); поэтому образование ядер 4He из ядер водорода (протонов) 1Н сопровождается выделением огромного количества энергии. Считают, что эта ядерная реакция: 41H = 4He +2β+ + 2ν [одновременно с 4He образуются 2 позитрона (β +) и 2 нейтрино (ν)] служит основным источником энергии Солнца и других схожих с ним звёзд. Благодаря этому процессу и накапливаются весьма значительные запасы Г. во Вселенной.
Физические и химические свойства. При нормальных условиях Г. - одноатомный газ без цвета и запаха. Плотность 0,17846 г/л, tkип - 268,93°С. Г. - единственный элемент, который в жидком состоянии не отвердевает при нормальном давлении, как бы глубоко его ни охлаждали. Наименьшее давление перехода жидкого Г. в твёрдый 2,5 Мн/м2 (25 am), tпл при этом равна - 272,1°С. Теплопроводность (при 0°С) 143,8 · 10-3 вт/см (K [343,4 · 10-6 кал/(см (град (сек)]. Радиус атома Г., определённый различными методами, составляет от 0,85 до 1,33 Å. В 1 л воды при 20°С растворяется около 8,8 мл Г. Энергия первичной ионизации Г. больше, чем у любого другого элемента, - 39,38 · 10-13дж (24,58 эв); сродством к электрону Г. не обладает. Жидкий Г., состоящий только из 4He, проявляет ряд уникальных свойств (см. ниже).
До настоящего времени попытки получить устойчивые химические соединения Г. оканчивались неудачами (см. Инертные газы). Спектроскопически доказано существование в разряде иона He2+. В 1967 советские исследователи В. П. Бочин, Н. В. Закурин, В. К. Капышев сообщили о синтезе в зоне дугового разряда за счёт реакции Г. с фтором, с BF3 или с RuF5 ионов HeF+, HeF22+ и HeF2+. Согласно расчёту, величина энергии диссоциации иона HeF+ равна 2,2 эв.
Получение и применение. В промышленности Г. получают из гелийсодержащих природных газов (в настоящее время эксплуатируются главным образом месторождения, содержащие > 0,1\% Г.). От других газов Г. отделяют методом глубокого охлаждения, используя то, что он сжижается труднее всех остальных газов.
Благодаря инертности Г. широко применяют для создания защитной атмосферы при плавке, резке и сварке активных металлов. Г. менее электропроводен, чем другой инертный газ - аргон, и поэтому электрическая дуга в атмосфере Г. даёт более высокие температуры, что значительно повышает скорость дуговой сварки. Благодаря небольшой плотности в сочетании с негорючестью Г. применяют для наполнения стратостатов. Высокая теплопроводность Г., его химическая инертность и крайне малая способность вступать в ядерную реакцию с нейтронами позволяют использовать Г. для охлаждения атомных реакторов. Жидкий Г. - самая холодная жидкость на Земле, служит хладагентом при проведении различных научных исследований. На определении содержания Г. в радиоактивных минералах основан один из методов определения их абсолютного возраста (см. Геохронология). Благодаря тому что Г. очень плохо растворим в крови, его используют как составную часть искусственного воздуха, подаваемого для дыхания водолазам (замена азота на Г. предотвращает появление кессонной болезни (См. Кессонная болезнь)). Изучаются возможности применения Г. и в атмосфере кабины космического корабля.
С. С. Бердоносов, В. П. Якуцени.
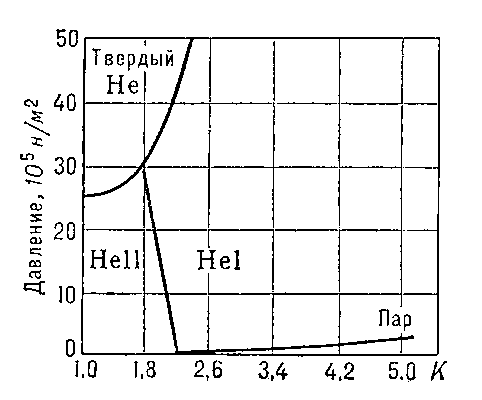
Гелий жидкий. Относительно слабое взаимодействие атомов Г. приводит к тому, что он остаётся газообразным до более низких температур, чем любой другой газ. Максимальная температура, ниже которой он может быть сжижен (его критическая температура TK), равна 5,20 К. Жидкий Г. - единственная незамерзающая жидкость: при нормальном давлении (рис. 1) Г. остаётся жидким при сколь угодно низких температурах и затвердевает лишь при давлениях, превышающих 2,5 Мн/м2 (25 am).
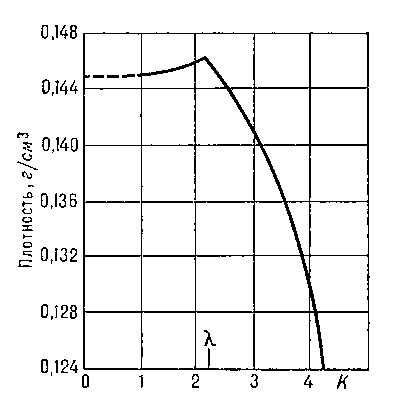
При температуре Tλ =2,19 К и нормальном давлении жидкий Г. испытывает Фазовый переход второго рода. Г. выше этой температуры называется Не I, ниже - Не II. При температуре фазового перехода наблюдаются аномальное возрастание теплоёмкости (т. н. λ-точка, рис. 2), излом кривой температурной зависимости плотности Г. (рис. 3) и др. характерные явления.
В 1938 П. Л. Капица открыл у Не II Сверхтекучесть - способность течь практически без вязкости. Объяснение этого явления было дано Л. Д. Ландау (1941) на основе квантовомеханических представлений о характере теплового движения в жидком Г.
При низких температурах это движение описывается как существование в жидком Г. элементарных возбуждений - Фононов (квантов звука), обладающих энергией ε·= hv (v - частота звука, h - постоянная Планка) и импульсом р = ε/c (с = 240 м/сек - скорость звука). Число и энергия фононов растут с повышением температуры Т. При T > 0,6 К появляются возбуждения с большими энергиями (ротоны), для которых зависимость ε(p) имеет нелинейный характер. Фононы и ротоны (см. Квазичастицы) обладают импульсом и, следовательно, массой. Отнесённая к 1 см, эта масса определяет плотность ρn т. н. нормальной компоненты жидкого Г. При низких температурах ρn стремится к нулю при Т → 0. Движение нормальной компоненты, как и обычного газа, имеет вязкостный характер. Остальная часть жидкого Г., т. н. сверхтекучая компонента, движется без трения; её плотность ρs = ρ - ρn. При Т → Tλ ρn → ρ, так что в λ-точке ρs обращается в нуль и сверхтекучесть исчезает (Не I - обычная вязкая жидкость).
Т. о., в жидком Г. одновременно могут происходить два движения с различными скоростями.
На основе этих представлений удаётся объяснить ряд наблюдаемых эффектов: при вытекании He II из сосуда через узкий капилляр температура в сосуде повышается, т.к. вытекает главным образом сверхтекучая компонента, не несущая с собой теплоты (т. н. механокалорический эффект); при создании разности температур между концами закрытого капилляра с Не II в нём возникает движение (термомеханический эффект) - сверхтекучая компонента движется от холодного конца к горячему и там превращается в нормальную, которая движется навстречу, при этом суммарный поток отсутствует. В жидком Г. может распространяться звук двух видов - обычный и т. н. Второй звук. При распространении второго звука в местах сгущения нормальной компоненты происходит разрежение сверхтекучей.
Всё сказанное относится к обычному Г., состоящему в основном из изотопа 4He. Более редкий изотоп 3He имеет иные, чем у 4He, квантовые свойства (см. Квантовая жидкость). Жидкий 3He - также незамерзающая жидкость (TK = 3,33 К), но не обладающая сверхтекучестью: вязкость 3He неограниченно возрастает с понижением температуры.
Л. П. Питаевский.
Лит.: Кеезом В., Гелий, пер. с англ., М., 1949; Фастовский В. Г., Ровинский А. Е., Петровский Ю. В., Инертные газы, М., 1964; Халатников И. М., Введение в теорию сверхтекучести, М., 1965; Смирнов Ю. Н., Гелий вблизи абсолютного нуля, "Природа", 1967, № 10, с. 70; Якуцени В. П., Геология гелия, Л., 1968. См. также лит. к ст. Инертные газы.
Рис. 1. Диаграмма состояния 4He.
Рис. 2. Теплоёмкость жидкого 4He вблизи λ-точки. Кривая имеет характерную форму, напоминающую греческую букву λ.
Рис. 3. Плотность ρ жидкого 4He вблизи λ-точки.
ГЕЛИЙ
(лат. Helium), Не, химический элемент VIII группы периодической системы, атомный номер 2, атомная масса 4,002602, относится к благородным газам; без цвета и запаха, плотность 0,178 г/л. Сжижается труднее всех известных газов (при -268,93 °С); единственное вещество, которое не отвердевает при нормальном давлении, как бы глубоко его ни охлаждали. Жидкий гелий - квантовая жидкость, обладающая сверхтекучестью ниже 2,17 К (-270,98 °С). В небольшом количестве гелий содержится в воздухе и земной коре, где он постоянно образуется при распаде урана и других ?-радиоактивных элементов (?-частицы - это ядра атомов гелия). Значительно более распространен гелий во Вселенной, напр., на Солнце, где он впервые был открыт (отсюда название: от греч. helios - Солнце). Получают гелий из природных газов. Применяют в криогенной технике, для создания инертных сред, в аэронавтике (для заполнения стратостатов, воздушных шаров и др.).
Википедия
Гелий

Ге́лий (химический символ — He, лат. Helium) — химический элемент 18-й группы (по устаревшей классификации — побочной подгруппы восьмой группы, VIIIB) первого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 2.
Простое вещество, гелий — инертный одноатомный газ без цвета, вкуса и запаха.
По распространённости во Вселенной и по лёгкости занимает второе место после водорода. Его температура кипения — самая низкая среди всех известных веществ.
Примеры употребления для Гелий
1. Гелий Одно из главных богатств восточных газовых месторождений - это гелий, уникальный, чрезвычайно востребованный химический элемент.
2. Гелий - идеальное топливо для атомных электростанций.
3. Гелий в качестве теплоносителя имеет большие преимущества.
4. Гелий Нус стал специалистом-металлургом, кандидатом наук.
5. Гелий-3 для целей транспортировки придется сжижать.






